CytoSelect™細胞浸潤アッセイキット
Cell Biolabs社の細胞浸潤アッセイキットには、ポアサイズ8 µmの上面が基底膜(Engelbreth-Holm-Swarm腫瘍細胞から単離されたタンパク質マトリックス)もしくはコラーゲンI、2種類のいずれかのゲルでコートされたボイデンチャンバーが使用されています。各キットにおいて24wellと96wellフォーマットをご用意しており、蛍光検出または比色検出により浸潤細胞を定量可能です。手動による細胞カウントは必要ありません。
操作手順
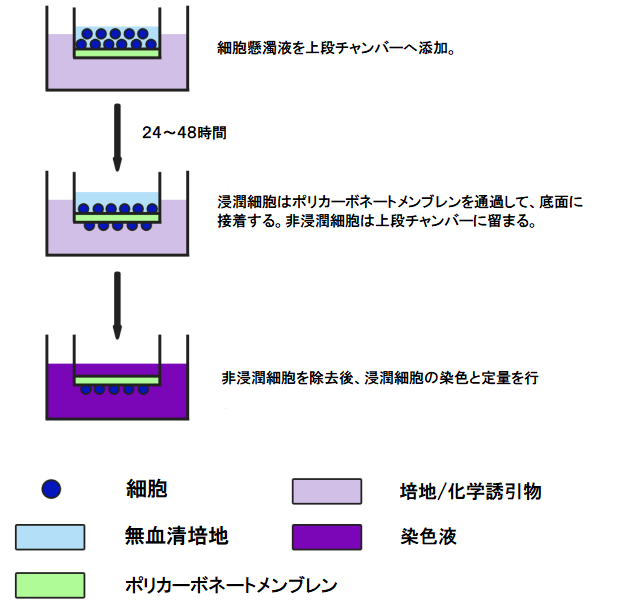
比色検出キット
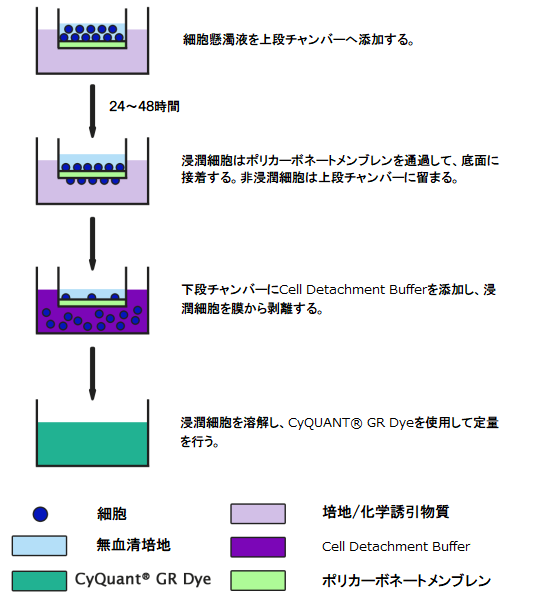
蛍光検出キット
製品外観
96-well Invasion Plate外観

測定例
製品番号:CBA-110
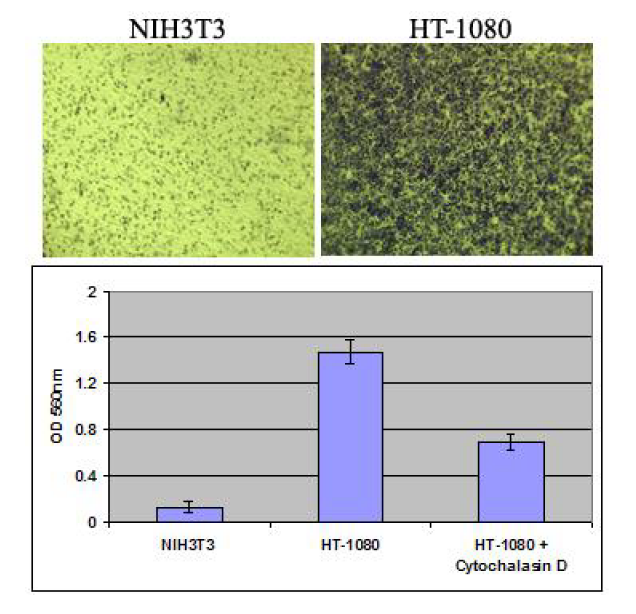
ヒト線維肉腫由来HT-1080細胞とNIH3T3(ネガティブコントロール)をそれぞれ300,000 cells/wellで播種し、2 µM Cytochalasin Dの存在下および非存在下で培養し、10% FBSの培地へと浸潤させた。基底膜上の浸潤細胞を染色し(画像データ)、色素を抽出した後にOD 560nmにて定量を行った。
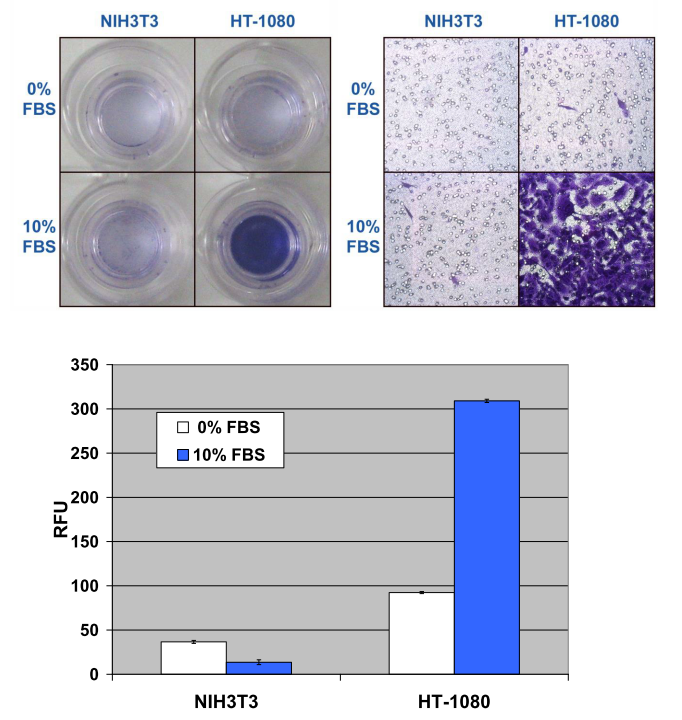
ヒト線維肉腫由来HT-1080細胞とNIH3T3(ネガティブコントロール)をそれぞれ200,000 cells/wellで播種し、10% FBSの培地へと浸潤させた。浸潤細胞を染色し(画像データ)、CyQuant® GR dyeによる定量を行った。
製品情報
キット内容
| 24 well 比色検出キット | 24 well 蛍光検出キット | 96 well 蛍光検出キット |
|---|---|---|
| ・Invasion Chamber Plate | ・Invasion Chamber Plate | ・96-well Invasion Plate |
| ・Cell Stain Solution | ・Cell Detachment Solution | ・96-well Cell Harvesting Tray |
| ・Extraction Solution | ・4X Lysis Buffer | ・Cell Detachment Solution |
| ・Cotton Swabs | ・CyQuant® GR Dye | ・4X Lysis Buffer |
| ・Forceps | ・Forceps | ・CyQuant® GR Dye |
製品ラインアップ
CytoSelect™細胞浸潤アッセイキット
| 詳細 | メーカー | 製品番号 | 製品名 | 容量 | 価格 | 在庫情報 | 保存温度 | 法規制 | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Cell Biolabs | CBA-110 | CytoSelect 24-well Cell Invasion Assay (Basement Membrane), Colorimetric | 12ASSY | ¥148,000 | 問合せ | 冷蔵 | ||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||
| Cell Biolabs | CBA-110-COL | CytoSelect 24-well Collagen Cell Invasion, Colorimetric | 12ASSY | ¥148,000 | 問合せ | 冷蔵 | ||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||
| Cell Biolabs | CBA-111 | CytoSelect 24-well Cell Invasion (Basement Membrane), Fluorometric | 12ASSY | ¥148,000 | 問合せ | 冷蔵 | ||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||
| Cell Biolabs | CBA-111-COL | CytoSelect 24-well Collagen Cell Invasion Assay, Fluorometric | 12ASSY | ¥148,000 | 問合せ | 冷蔵 | ||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||
| Cell Biolabs | CBA-112 | CytoSelect 96-well Cell Invasion Assay (Basement Membrane), Fluorometric | 96ASSY | ¥196,000 | 問合せ | 冷蔵 | ||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||
| Cell Biolabs | CBA-112-COL | CytoSelect 96-well Collagen Cell Invasion Assay, Fluorometric | 96ASSY | ¥196,000 | 問合せ | 冷蔵 | ||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||
CytoSelect™細胞走化性/浸潤アッセイ コンボキット
※ポアサイズ8 μmの走化性アッセイ用プレートと基底膜がコートされた細胞浸潤アッセイ用プレートが含まれています。
| 詳細 | メーカー | 製品番号 | 製品名 | 容量 | 価格 | 在庫情報 | 保存温度 | 法規制 | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Cell Biolabs | CBA-100-C | CytoSelect 24-well Cell Migration and Invasion Assay (8 μm), Colorimetric, Combo Kit | 1KT | ¥254,000 | 問合せ | 冷蔵 | ||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||
| Cell Biolabs | CBA-101-C | CytoSelect 24-well Cell Migration and Invasion Assay (8 μm), Fluorometric, Combo Kit | 1KT | ¥254,000 | 問合せ | 冷蔵 | ||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||
| Cell Biolabs | CBA-106-C | CytoSelect 96-well Cell Migration and Invasion Assay (8 μm), Fluorometric, Combo Kit | 1KT | ¥301,000 | 問合せ | 冷蔵 | ||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||
FAQ:細胞浸潤アッセイキット
ボイデンチャンバーを使用した実験を行った経験がありません。24well、96wellのフォーマットが用意されていますが、どちらを使用した方がよいでしょうか?
細胞浸潤について研究の初期段階にあり、試験条件の最適化が済んでいない場合は、24wellフォーマットから使用することをお勧めします。条件の最適化が完了し、アッセイプロトコルに慣れてから96wellフォーマットに移行することも可能です。
コラーゲンがメンブレンの下側にコートされている製品(製品番号:CBA-101-COL)と、コラーゲンがメンブレンの上側にコートされている製品(製品番号:CBA-111-COL)の違いは何ですか?
Cell Biolabs社では4種類の細胞遊走アッセイキットをご提供しております。各アッセイキットの詳細はこちらをご覧ください。製品番号:CBA-101-COLは、固定化されたECMタンパク質が、細胞を移動する化学誘引物質として作用する、走触性(haptotaxis)を測定するように設計されております。一方、製品番号:CBA-111-COLは細胞の浸潤(invasion)を測定するように設計されております。細胞浸潤は、細胞の移動、ECMの分解、タンパク質分解、およびECMを介した隣接組織への細胞の移動を含む、より複雑なプロセスです。このアッセイでは、細胞はメンブレン上部のコーティングを消化して移動(浸潤)するため、MMPなどのプロテイナーゼを発現できなければなりません。
96wellフォーマットの比色検出キットはありますか?
24wellフォーマットでのみ比色検出キットをご提供しております。残念ながら比色検出は96wellフォーマットでアッセイを行うのに十分な感度がありません。
基底膜、コラーゲンコーティングのうち、どちらを選択すればよいでしょうか?
ほとんどの細胞浸潤研究では、基底膜がコーティングされたボイデンチャンバーを使用します。コラーゲンゲルでコーティングされたボイデンチャンバーは、コラーゲンによって媒介される細胞浸潤の研究用にご提供しております。
なぜ無血清培地がボイデンチャンバーの上部に使用され、10%血清を含む培地が下部に使用されているのですか?
血清には多くのサイトカインと成長因子が含まれており、一般的に細胞遊走および浸潤アッセイの化学誘引物質として使用されます。上部チャンバーの無血清培地と下部チャンバーの10%血清を含む培地の間に化学誘引物質の勾配ができることで、細胞にゲル層を介した浸潤を促します。
アッセイの前に、無血清培地で細胞を培養する必要がありますか?
血清には多くのサイトカインと成長因子が含まれており、通常飢餓状態の細胞は化学誘引物質に対してよく反応を示すため、一部の研究者は細胞(がん細胞など)を飢餓状態にします。必ずしもOvernightで飢餓状態にする必要はなく、代わりに無血清培地に細胞を再懸濁することもできます。
ECMの構成成分を教えて下さい。
基底膜コーティングの細胞浸潤アッセイキットのインサートwellは、マトリゲルと同じECMゲルでコーティングされています。ECM抽出物は、マウスEngelbreth-Holm-Swarm腫瘍細胞から調整され、主成分としてラミニン、コラーゲンIV、ヘパラン硫酸プロテオグリカン、エンタクチン、およびその他の微量成分を含んでいます。
FAQ:細胞浸潤アッセイキット(24wellフォーマット)
比色検出キットと蛍光検出キットではどちらが高感度ですか?
蛍光検出キットは比色検出キットよりも感度が高くなりますが、細胞染色後、色素抽出の前に手動でカウントすることができます。手動カウントは蛍光検出を含むどの検出方法より感度が高くなります。
比色検出キットで行う染色はどのようなものですか?
Cell Biolabs社の細胞浸潤アッセイキットは細胞の生死に関係なく、細胞を固定して染色を行う染色液を使用しています。色素は水で洗い流せませんが、キット付属の抽出液には容易に溶解します。抽出液はELISAリーダーにて560 nmの吸光度を読み取ることで測定します。
キット構成品のチャンバープレートはストリップウェルフォーマットですか?
ECMのチャンバープレートは12個の個別のインサートを含む24wellプレートです。これらのインサートは取り外し可能で、使用しないインサートは4℃で保管できます。
ポジティブコントロールとして使用できるHT-1080以外の細胞株はありますか?
HT-1080を使用できない場合は、MDA-231を浸潤細胞のポジティブコントロールとして使用できます。
インサートの非特異的な染色を取り除くにはどうすればよいですか?
インサートの染色後、綿棒で非特異的染色を洗浄することで、染色された細胞が見やすくなります。また、綿棒を水で濡らし、ベンチにしっかりと押し付けて平らにすることで、綿棒がインサートの角に入りやすくなります。すでに色素抽出が行われている場合でも、浸潤細胞はインサートの底に付着するため、インサートを再染色することができます。非特異的染色の問題が解決しない場合は目視による計測も可能です。
インサートは再利用できますか?
インサートは基底膜タンパク質でコーティングされているおり、再利用はできません。基底膜タンパク質は実験を行うことで、無傷ではなくなります。実験後の基底膜コーティングはキットには12個のインサートが含まれており、未使用のインサートは4℃で保管できます。
浸潤した細胞が斑状に分布するのは正常ですか?
正常です。走化性アッセイ(Migration assay)の場合、ほとんどの細胞は染色後、均一に分布します。一方、浸潤アッセイ(Invasion Assay)の場合は、細胞がECM層を貫通する必要があるため、走化性アッセイとは異なります。浸潤アッセイではECM層を消化して穴を開ける非常に活性の高い細胞がいくつかあり、それによって他の細胞が通り抜けることができるようになります。
浸潤後、血球計算盤で細胞生存率を測定できますか?
細胞は細胞剥離ステップ後も生存可能であり、細胞剥離バッファー中の一部を使用して細胞生存率を測定できます。この段階では細胞は生存していますが、浸潤した細胞の濃度が低く、血球計算盤の感度が低いため生存率を測定するのが難しい場合があります。血球計算盤に表示される細胞1つは、10,000 cells/mlに相当します。走化性アッセイおよび浸潤アッセイでは、最も活性の高い細胞株の場合であっても、移動する細胞はわずか5~10%と予想できます。アッセイで最大量である300,000個の細胞を使用し、その10%が移動した場合でも、30,000個の細胞しか得ることができません。
アッセイに使用する細胞は、プロトコールに記載されているのものとは別の培地で培養する必要があるのですが、問題ないでしょうか?
アッセイを始める前に、無血清培地にて細胞懸濁液を調製します。無血清培地で細胞を培養する必要はありません。
FAQ:細胞浸潤アッセイキット(96wellフォーマット)
96wellの浸潤チャンバープレートのうち、全てのwellを一回の実験で使用する必要がありますか?
はい。全てのwellを一回の実験で使用する必要があります。コーティング済みのインサートは、すべて1つのプレートに収められているため、浸潤アッセイを行う場合使用されていないwellも、37℃で一晩インキュベートする必要があります。未使用wellの基底膜層は、湿度の高い環境で長時間インキュベートすると不安定になるため、再利用できません。96wellフォーマットの浸潤アッセイキットは、ハイスループットを行うラボ向けに特別に設計されています。
24wellフォーマットの浸潤アッセイキットでは、12アッセイを一度に行う必要がないように、インサートを個別に取り外しできるようにしています。取り外し可能なインサートは、他の24well滅菌培養プレートと併せて使用することができます。
CaCl2、MgCl2、BSAを培地に添加する必要はありますか?
浸潤アッセイではBSAを培地に添加する必要はありません。しかし、CaCl2とMgCl2は、細胞接着に関与するインテグリン受容体の活性化に必要なため、重要です。ほとんどの培地にはCaCl2とMgCl2が含まれていますが、それらが含まれていない場合は添加する必要があります。
参考文献
- Alburquerque-González, B. et al. (2021). The FDA-Approved Antiviral Raltegravir Inhibits Fascin1-Dependent Invasion of Colorectal Tumor Cells In Vitro and In Vivo. Cancers. 13(4):861. doi: 10.3390/cancers13040861 (#CBA-110).
- Bastos, D.C. et al. (2020). Genetic ablation of FASN attenuates the invasive potential of prostate cancer driven by Pten loss. J Pathol. doi: 10.1002/path.5587 (#CBA-110).
- Lim, W.C. et al. (2020). Polysaccharide isolated from persimmon leaves (Diospyros kaki Thunb.) suppresses TGF-β1-induced epithelial-to-mesenchymal transition in A549 cells. Int J Biol Macromol. S0141-8130(20)34246-X. doi: 10.1016/j.ijbiomac.2020.08.155 (#CBA-110).
- Daso, R.E. et al. (2020). Self-Assembled Peptide Based Biocomposites for Near Infra-red Light Triggered Drug Release to Tumor Cells. Biotechnol J. doi: 10.1002/biot.202000128 (#CBA-110).
- Tang, H. et al (2020). MiR-4328 inhibits proliferation, metastasis and induces apoptosis in keloid fibroblasts by targeting BCL2 expression. Open Life Sci. 15(1):638-646. doi: 10.1515/biol-2020-0056 (#CBA-110).
- Zhou, R. et al. (2020). ADAM9 Mediates Triple-Negative Breast Cancer Progression via AKT/NF-κB Pathway. Front Med (Lausanne). 7:214. doi: 10.3389/fmed.2020.00214 (#CBA-110).
- Wang, F. et al. (2020). Combination therapy of gefitinib and miR-30a-5p may overcome acquired drug resistance through regulating the PI3K/AKT pathway in non-small cell lung cancer. Ther Adv Respir Dis. 14:1753466620915156. doi: 10.1177/1753466620915156 (#CBA-110).
- Chen, C. et al. (2020). The circular RNA 001971/miR-29c-3p axis modulates colorectal cancer growth, metastasis, and angiogenesis through VEGFA. J Exp Clin Cancer Res. 39(1):91. doi: 10.1186/s13046-020-01594-y (#CBA-110).
- Lim, W.C. et al. (2020). Catechol inhibits epidermal growth factor-induced epithelial-to-mesenchymal transition and stem cell-like properties in hepatocellular carcinoma cells. Sci Rep. 10(1):7620. doi: 10.1038/s41598-020-64603-2 (#CBA-110).
- Díaz-García, D. et al. (2020). Mesoporous silica nanoparticles functionalized with a dialkoxide diorganotin(IV) compound: In search of more selective systems against cancer cells. Micropor Mesopor Mat. doi: 10.1016/j.micromeso.2020.110154 (#CBA-110).
- Shimoyama, H. et al. (2020). Partial silencing of fucosyltransferase 8 gene expression inhibits proliferation of Ishikawa cells, a cell line of endometrial cancer. Biochem Biophys Rep. 22:100740. doi: 10.1016/j.bbrep.2020.100740 (#CBA-110).
- Felsenstein, M. et al. (2020). Generation and characterization of a cell line from an intraductal tubulopapillary neoplasm of the pancreas. Lab Invest. doi: 10.1038/s41374-020-0372-0 (#CBA-110).
- Montoro-García, S. et al. (2020). Novel anti-invasive properties of a Fascin1 inhibitor on colorectal cancer cells. J Mol Med (Berl). doi: 10.1007/s00109-020-01877-z (#CBA-110).
- Olgun, N.S. et al. (2020). Mild Steel and Stainless Steel Welding Fumes Elicit Pro-Inflammatory and Pro-Oxidant Effects in First Trimester Trophoblast Cells. Am J Reprod Immunol. doi: 10.1111/aji.13221 (#CBA-110).
- Gan, L. et al. (2019). Vitamin C Inhibits Triple-Negative Breast Cancer Metastasis by Affecting the Expression of YAP1 and Synaptopodin 2. Nutrients. 11(12). pii: E2997. doi: 10.3390/nu11122997 (#CBA-110).
- Armignacco, R. et al. (2019). The Adipose Stem Cell as a Novel Metabolic Actor in Adrenocortical Carcinoma Progression: Evidence from an In Vitro Tumor Microenvironment Crosstalk Model. Cancers (Basel). 11(12). pii: E1931. doi: 10.3390/cancers11121931 (#CBA-110).
- Unterleuthner, D. et al. (2019). Cancer-associated fibroblast-derived WNT2 increases tumor angiogenesis in colon cancer. Angiogenesis. doi: 10.1007/s10456-019-09688-8 (#CBA-110).
- Ritter, A. et al. (2019). Subcutaneous and Visceral Adipose-Derived Mesenchymal Stem Cells: Commonality and Diversity. Cells. 8(10). pii: E1288. doi: 10.3390/cells8101288 (#CBA-110).
- Ritter, A. et al. (2019). Restoration of primary cilia in obese adipose-derived mesenchymal stem cells by inhibiting Aurora A or extracellular signal-regulated kinase. Stem Cell Res Ther. 10(1):255. doi: 10.1186/s13287-019-1373-z (#CBA-110).
- Ling, X. et al. (2019). miR‑505 suppresses prostate cancer progression by targeting NRCAM. Oncology Reports. doi: 10.3892/or.2019.7231 (#CBA-110).
- Hoock, S.C. et al. (2019). RITA modulates cell migration and invasion by affecting focal adhesion dynamics. Mol Oncol. doi: 10.1002/1878-0261.12551 (#CBA-110).
- Li, X. et al. (2019). Colonic Injuries Induced by Inhalational Exposure to Particulate‐Matter Air Pollution. Advanced Science. 1900180. doi: 10.1002/advs.201900180 (#CBA-110).
- Huang, J. et al. (2020). Identification of the fatty acid synthase interaction network via iTRAQ-based proteomics indicates the potential molecular mechanisms of liver cancer metastasis. Cancer Cell Int. 20:332. doi: 10.1186/s12935-020-01409-2 (#CBA-111).
- Katara, G.K. et al. (2019). Interleukin-22 promotes development of malignant lesions in a mouse model of spontaneous breast cancer. Mol Oncol. doi: 10.1002/1878-0261.12598 (#CBA-111).
- Millien, G. et al. (2018). ETS1 regulates Twist1 transcription in a Kras G12D /Lkb1-/- metastatic lung tumor model of non-small cell lung cancer. Clin Exp Metastasis. doi: 10.1007/s10585-018-9912-z (#CBA-111).
- Paluszczak, J., et al. (2017). Lichen-derived caperatic acid and physodic acid inhibit Wnt signaling in colorectal cancer cells. Mol Cell Biochem. 441:109–124. doi: 10.1007/s11010-017-3178-7 (#CBA-111).
- Steury, M. et al. (2017). G-protein-coupled receptor kinase-2 is a critical regulator of TNFα signaling in colon epithelial cells. Biochem. J. 474(14):2301-2313 (#CBA-111).
- Lopez-Campistrous, A. et al. (2016). PDGFRα regulates follicular cell differentiation driving treatment resistance and disease recurrence in papillary thyroid cancer. EBioMed. doi:10.1016/j.ebiom.2016.09.007 (#CBA-111).
- Engel, N. et al. (2016). Antitumor evaluation of two selected Pakistani plant extracts on human bone and breast cancer cell lines. BMC Complement Altern Med. doi:10.1186/s12906-016-1215-9 (#CBA-111).
- Almami, A. et al. (2016). ING3 is associated with increased cell invasion and lethal outcome in ERG-negative prostate cancer patients. Tumor Biol. doi:10.1007/s13277-016-4802-y (#CBA-111).
- Price, J.C. et al. (2020). Notch3 signaling promotes tumor cell adhesion and progression in a murine epithelial ovarian cancer model. PLoS One. 15(6):e0233962. doi: 10.1371/journal.pone.0233962 (#CBA-110-COL).
- Gan, L. et al. (2019). Vitamin C Inhibits Triple-Negative Breast Cancer Metastasis by Affecting the Expression of YAP1 and Synaptopodin 2. Nutrients. 11(12). pii: E2997. doi: 10.3390/nu11122997 (#CBA-110-COL).
- Mallikarjuna, P. et al. (2019). Interactions between TGF-β type I receptor and hypoxia-inducible factor-α mediates a synergistic crosstalk leading to poor prognosis for patients with clear cell renal cell carcinoma. Cell Cycle. 18(17):2141-2156. doi: 10.1080/15384101.2019.1642069 (#CBA-110-COL).
- Aripaka, K. et al. (2019). TRAF6 function as a novel co-regulator of Wnt3a target genes in prostate cancer. EBioMedicine. pii: S2352-3964(19)30427-X. doi: 10.1016/j.ebiom.2019.06.046 (#CBA-110-COL).
- Orlandella, F.M. et al. (2019). miR-650 promotes motility of anaplastic thyroid cancer cells by targeting PPP2CA. Endocrine. doi: 10.1007/s12020-019-01910-3 (#CBA-110-COL).
- Zang, G. et al. (2019). PKCζ facilitates lymphatic metastatic spread of prostate cancer cells in a mice xenograft model. Oncogene. doi: 10.1038/s41388-019-0722-9 (#CBA-110-COL).
- Hübner, M. et al. (2018). Intronic miR-744 Inhibits Glioblastoma Migration by Functionally Antagonizing Its Host Gene MAP2K4. Cancers (Basel). 10(11). pii: E400. doi: 10.3390/cancers10110400 (#CBA-110-COL).
- Djuzenova, C. S. et al. (2015). Actin cytoskeleton organization, cell surface modification and invasion rate of 5 glioblastoma cell lines differing in PTEN and p53 status. Exp Cell Res. 330:346-357 (#CBA-110-COL).
- Mu, Y. et al. (2015). TGFβ-induced phosphorylation of Par6 promotes migration and invasion in prostate cancer cells. Br J Cancer. doi: 10.1038/bjc.2015.71 (#CBA-110-COL).
- Djuzenova, C. S. et al. (2015). Actin cytoskeleton organization, cell surface modification and invasion rate of 5 glioblastoma cell lines differing in PTEN and p53 status. Exp Cell Res. 330:346-357 (#CBA-110-COL).
- Li, P. et al. (2015). A tight control of Rif1 by Oct4 and Smad3 is critical for mouse embryonic stem cell stability.Cell Death Dis. 6:e1588 (#CBA-110-COL).
- Zhen, Q. et al. (2020). EPAS1 promotes peritoneal carcinomatosis of non-small-cell lung cancer by enhancing mesothelial-mesenchymal transition. Strahlenther Onkol. doi: 10.1007/s00066-020-01665-1 (#CBA-111-COL).
- Negro, G. et al. (2020). Molecular heterogeneity in breast carcinoma cells with increased invasive capacities. Radiol Oncol. 54(1):103‐118. doi: 10.2478/raon-2020-0007 (#CBA-111-COL).
- Nii, T. et al. (2020). A co-culture model of 3D TAM and 3D CAF combined with biomolecules release for cancer cell migration. Tissue Eng Part A. doi: 10.1089/ten.TEA.2020.0095.
- Nii, T. et al. (2020). A cancer invasion model of cancer-associated fibroblasts aggregates combined with TGF-β1 release system. Regen Ther. 14:196-204. doi: 10.1016/j.reth.2020.02.003.
- Tanaka, E. et al. (2019). Expression of circular RNA CDR1‑AS in colon cancer cells increases cell surface PD‑L1 protein levels. Oncol Rep. doi: 10.3892/or.2019.7244.
- Pereira, M.C. et al. (2019). In Vitro Analysis of the Combinatory Effects of Novel Aminonaphthoquinone Derivatives and Curcumin on Breast Cancer Progression. Anticancer Res. 40(1):229-238. doi: 10.21873/anticanres.13944.
- Kowolik, C.M. et al. (2019). Attenuation of hedgehog/GLI signaling by NT1721 extends survival in pancreatic cancer. J Exp Clin Cancer Res. 38(1):431. doi: 10.1186/s13046-019-1445-z.
- Tanaka, Y. et al. (2019). Differential Prognostic Relevance of Promoter DNA Methylation of CDO1 and HOPX in Primary Breast Cancer. Anticancer Res. 39(5):2289-2298. doi: 10.21873/anticanres.13345.
- Ishii, S. et al. (2017). The H19-PEG10/IGF2BP3 axis promotes gastric cancer progression in patients with high lymph node ratios. Oncotarget. 8(43):74567-74581. doi: 10.18632/oncotarget.20209.
- Chueca, E. et al. (2016). Proton pump inhibitors display antitumor effects in Barrett's Adenocarcinoma cells. Front. Pharmacol. 7:452.
- Zhou, Z.L. et al. (2016). Nanomechanical measurement of adhesion and migration of leukemia cells with phorbol 12-myristate 13-acetate treatment. Int. J. Nanomedicine 11:6533-6545.
- Smith, R.W. et al. (2016). Therapeutic potential of GW501516 and the role of Peroxisome proliferator-activated receptor ß/d and B-cell lymphoma 6 in inflammatory signaling in human pancreatic cancer cells. Biochem. Biophys. 8:395-402.
- Saha, S. K. et al. (2016). KRT19 directly interacts with β-catenin/RAC1 complex to regulate NUMB-dependent NOTCH signaling pathway and breast cancer properties. Oncogene. doi:10.1038/onc.2016.221.
- Hirahata, M. et al. (2016). PAI-1, a target gene of miR-143, regulates invasion and metastasis by upregulating MMP-13 expression of human osteosarcoma. Cancer Med. doi:10.1002/cam4.651.
- Knappe, N. et al. (2016). Directed de-differentiation using partial reprogramming induces invasive phenotype in melanoma cells. Stem Cells.doi:10.1002/stem.2284.
- Adam, M. G. et al. (2015). SIAH ubiquitin ligases regulate breast cancer cell migration and invasion independent of the oxygen status. Cell Cycle. 14:3734-3747.
- Yamamoto, K. et al. (2014). miR-379/411 cluster regulates IL-18 and contributes to drug resistance in malignant pleural mesothelioma. Oncol Rep. 32:2365-2372.
- Takeuchi, S. et al. (2014). Significance of osteopontin in the sensitivity of malignant pleural mesothelioma to pemetrexed. Int J Oncol. 44:1886-1894.
- Ichijo, S. et al. (2014). Activation of the RhoB signaling pathway by thyroid hormone receptor β in thyroid cancer cells. PLoS One. 9:e116252.
- Ruan, M. et al. (2014). Activation of Toll-like receptor-9 promotes cellular migration via up-regulating MMP-2 expression in oral squamous cell carcinoma. PLoS One. 9:e92748.
- Ismail, I. A. et al. (2014). DJ-1 upregulates breast cancer cell invasion by repressing KLF17 expression. Br J Cancer. 110:1298-1306.
- Leung, W.H. et al. (2013). Modulation of NKG2D Ligand Expression and Metastasis in Tumors by Spironolactone via RXR{gamma} Activation. J. Exp. Med. 210:2675-2692.
- Nakayama, K. et al. (2013). cAMP-response Element-binding Protein (CREB) and NF-{kappa}B Transcription Factors Are Activated during Prolonged Hypoxia and Cooperatively Regulate the Induction of Matrix Metalloproteinase MMP1. J. Biol. Chem. 288:22584-22595.
- Chen, Z. et al. (2012). The Iron Chelators Dp44mT and DFO Inhibit TGF-β-induced Epithelial-Mesenchymal Transition via Up-Regulation of N-Myc Downstream-regulated Gene 1 (NDRG1). J.Biol.Chem. 287:17016-17028.
- Beach, J.R. et al. (2011). Myosin II Isoform Switching Mediates Invasiveness after TGF-ß-Induced Epithelial-Mesenchymal Transition. PNAS 108:17991-17996.
- Eckstein, N. et al. (2009). Hyperactivation of the Insulin-like Growth Factor Receptor I Signaling Pathway is an Essential Event for Cisplatin Resistance of Ovarian Cancer Cells. Cancer Res. 69:2996-3003.
- Lam, K.K.W. et al. (2009). Glycodelin-A as a Modulator of Trophoblast Invasion. Hum. Reprod. 24:2093-2103.
- Thal, D.R. et al. (2008). Expression of Coronin-3 (Coronin-1C) in Diffuse Gliomas is Related to Malignancy. J. Pathol. 214:415-424.
- Neil, J.R. et al. (2008). Cox-2 Inactivates Smad Signaling and Enhances EMT Stimulated by TGFß through a PGE2-Dependent Mechanism. Carcinogenesis 29:2227-2235.
- Negro, G. et al. (2020). Molecular heterogeneity in breast carcinoma cells with increased invasive capacities. Radiol Oncol. 54(1):103‐118. doi: 10.2478/raon-2020-0007.
- Matsui, A. et al. (2018). Prolonged engraftment of transplanted hepatocytes in the liver by transient pro-survival factor supplementation using ex vivo mRNA transfection. J Control Release. 285:1-11. doi: 10.1016/j.jconrel.2018.06.033.
- Ohishi, T. et al. (2017). Tankyrase-binding protein TNKS1BP1 regulates actin cytoskeleton rearrangement and cancer cell invasion. Cancer Res. doi: 10.1158/0008-5472.CAN-16-1846.
- Ben-David, U. et al. (2016). The landscape of chromosomal aberrations in breast cancer mouse models reveals driver-specific routes to tumorigenesis. Nat Commun. doi:10.1038/ncomms12160.
- Ho, P. W. et al. (2015). Knockdown of PTHR1 in osteosarcoma cells decreases invasion and growth and increases tumor differentiation in vivo. Oncogene. 34:2922-2933.
- Ishiba, T. e. al. (2014). Periostin Suppression Induces Decorin Secretion Leading to Reduced Breast Cancer Cell Motility and Invasion. Sci Rep. 4:7069.
- Ziemann, A. et al. (2013). CRN2 Enhances the Invasiveness of Glioblastoma Cells. Neuro Oncology. 10.1093/neuonc/nos388 (#CBA-112-COL).
- Liu, X. et al. (2013). Antiproliferative, Antiinvasive, and Proapoptotic Activity of Folate Receptor α-Targeted Liposomal Doxorubicin in Nonfunctional Pituitary Adenoma Cells. Endocrinology. 154:1414-1423 (#CBA-112-COL).
- Ziemann, A. et al. (2013). CRN2 Enhances the Invasiveness of Glioblastoma Cells. Neuro Oncology. 10.1093/neuonc/nos388 (#CBA-112-COL).
